Jak pojmenovat chemické sloučeniny
Autor:
Laura McKinney
Datum Vytvoření:
2 Duben 2021
Datum Aktualizace:
26 Červen 2024

Obsah
- stupně
- Metoda 1 Nomenklatura iontových sloučenin
- Metoda 2 Názvosloví polyatomových sloučenin
- Metoda 3 Názvosloví kovalentních sloučenin
Úspěch v oblasti chemie vyžaduje vědět, jak pojmenovat základní chemické sloučeniny. Tato příručka vám poskytuje základní pravidla pro proces pojmenování chemických sloučenin a způsob, jak přiřadit názvy sloučeninám, které vám nejsou známy.
stupně
Metoda 1 Nomenklatura iontových sloučenin
- Co je iontová sloučenina? Iontové sloučeniny se skládají z kovu a nekovu. Pak se podívejte do Periodické tabulky prvků, abyste věděli, které kategorie patří k prvkům přítomným ve směsi.
-

Vytvořte jméno. Nic není snazší než pojmenování iontové sloučeniny dvou prvků. První část názvu sloučeniny skutečně odpovídá názvu nekovového prvku nesoucího příponu „ure“, zatímco druhá část odpovídá názvu kovového prvku. Výjimky jsou: oxid, fosfid, nitrid, sulfid.- Příklad: Al2O3, al2 = Hliník; O3 = Kyslík. Název sloučeniny bude tedy „oxid hlinitý“.
-
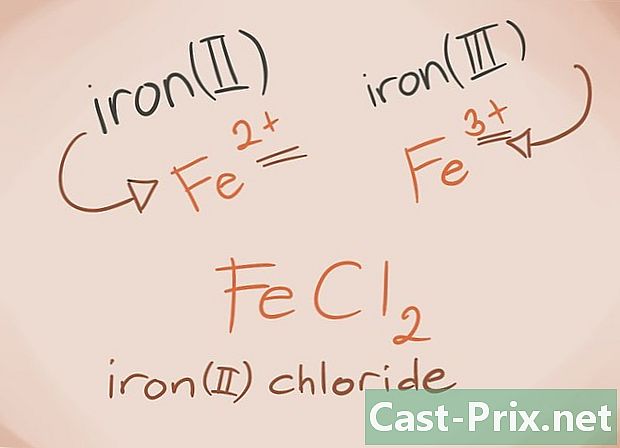
Znát přechodné kovy. Přechodné kovy jsou ty, které se nacházejí v blocích D a F periodické tabulky. Ve jménu sloučeniny je poplatek za tyto kovy psán římskými číslicemi. Je to proto, že přechodné kovy mohou nést větší zatížení a vytvářet více sloučeniny.- Příklad: FeCl2 a FeCl3, Fe = železo; cl2 = -2 chlorid; cl3 = Chlorid -3. Jako jména bude existovat chlorid železitý (II) a chlorid železitý (III).
Metoda 2 Názvosloví polyatomových sloučenin
-

Musíte pochopit, co je polyatomická sloučenina. Polyatomické sloučeniny jsou sloučeniny tvořené skupinou datomů asociovaných navzájem; celá skupina nesoucí náboj je kladná nebo záporná. Na polyatomické sloučeniny pak můžete uplatnit tři základní akce:- K první části sloučeniny můžete přidat vodík. Slovo „vodík“ je skutečně přidáno na začátek názvu sloučeniny. Tím se sníží hodnota záporného náboje o jeden. Například „uhličitanový“ CO3 se stává "hydrogenuhličitanem" HCO3.

- Ze sloučeniny můžete také odstranit kyslík. Zatížení se nezmění, ale přípona „-ate“ sloučeniny se změní na „-ique“. Například transformace: NE3 v NO2 jdeme z dusičnanů na dusičnany. "

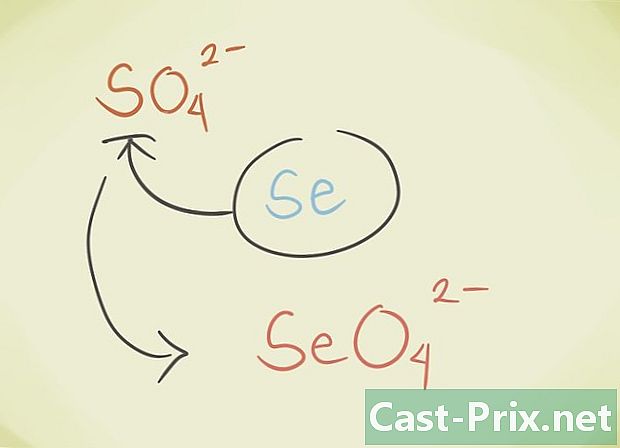
- Centrální latome sloučeniny můžete nahradit jiným atomem patřícím do stejné periodické skupiny. Například síran sodný4 může být nahrazen Selenate SeO4.
- K první části sloučeniny můžete přidat vodík. Slovo „vodík“ je skutečně přidáno na začátek názvu sloučeniny. Tím se sníží hodnota záporného náboje o jeden. Například „uhličitanový“ CO3 se stává "hydrogenuhličitanem" HCO3.
-

Zapamatujte si nejběžnější skupiny dionů. Níže uvedené skupiny se používají k vytvoření většiny polyatomických sloučenin. Po rostoucím pořadí jejich záporného náboje máme:- hydroxidové ionty: OH
- dusičnanové ionty: NO3
- Hydrogenuhličitanové ionty: HCO3
- permanganátové ionty: MnO4
- uhličitanové ionty: CO3
- chromátové ionty: CrO4
- dichromátové ionty: Cr2O7
- síranové ionty: SO4
- siřičitanové ionty: SO3
- thiosíranové ionty: S2O3
- Fosfátové ionty: PO4
- amonné ionty: NH4
- Z výše uvedeného seznamu vytvořte složené názvy. Vytvořte přidružení názvu ke kterékoli z položek souvisejících se skupinou. Pokud je prvek umístěn před iontovou skupinu, bude název prvku jednoduše přidán na začátek názvu sloučeniny.
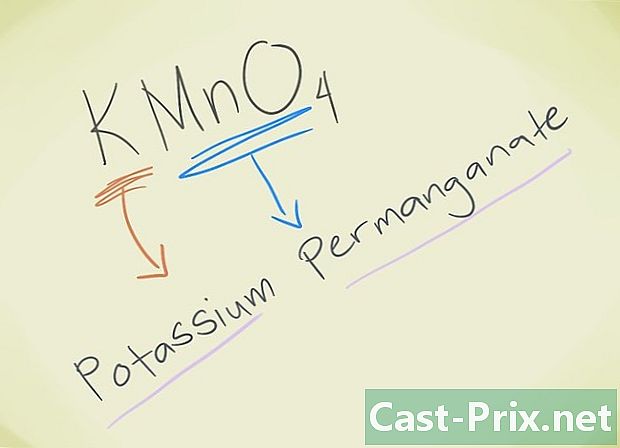
- Příklad: KMnO4, Musíte být schopni vědět toho lva MnO4 odpovídá manganistanu lva. K znamená draslík. Takže vaše sloučenina se bude jmenovat Permanganate draslík.
- Příklad: NaOH. Pravděpodobně jste zde pochopili, že je to OHOH. Na je sodík, takže sloučenina se bude jmenovat hydroxid sodný.

- Příklad: KMnO4, Musíte být schopni vědět toho lva MnO4 odpovídá manganistanu lva. K znamená draslík. Takže vaše sloučenina se bude jmenovat Permanganate draslík.
Metoda 3 Názvosloví kovalentních sloučenin
-
Co je kovalentní sloučenina? Kovalentní sloučeniny jsou výsledkem asociace alespoň dvou nekovových prvků. Název sloučeniny je určován číselnými údaji, které ji tvoří. Řecká předpona vedle tohoto názvu označuje počet molekul přítomných ve sloučenině. -
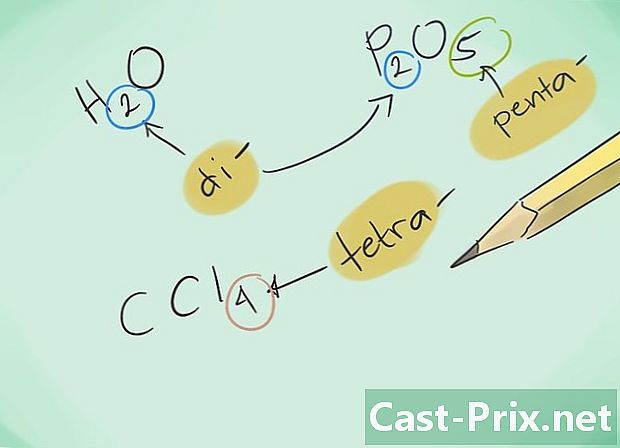
Seznamte se s předponami. Zapamatujte si následující předpony pro sloučeniny s 1 až 8 atomy:- 1 atom - „Mono-“
- 2 atomy - „Di-“
- 3 atomy - „Tri-“
- 4 atomy - „Tetra-“
- 5 atomů - „Penta-“
- 6 atomů - "hexa"
- 7 atomů - „Hepta-“
- 8 atomů - „Octa-“
- Potom pojmenujte sloučeniny. Výslednou sloučeninu pojmenujte pomocí příslušných předpon. Předpony mají být naroubovány na každý z prvků tvořících sloučeninu s několika atomy.
- Příklad: CO se vrátí na oxid uhelnatý, zatímco CO2 označí oxid uhličitý.
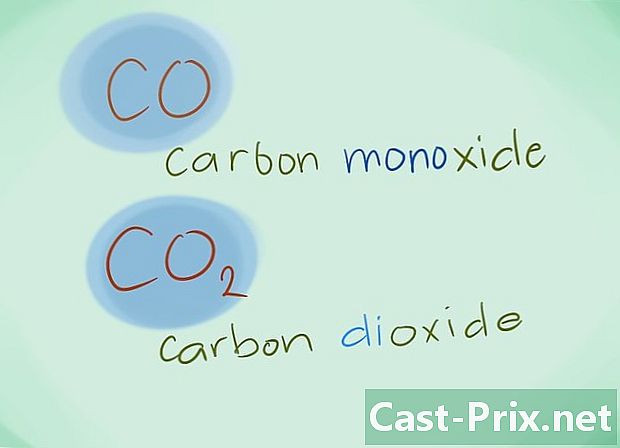
- Příklad: N2S3 by odpovídal trisulfidu dusnatému.

- Ve většině případů lze předponu „mono“ vynechat; to, více než jakýkoli nedostatek předpony, naznačuje, že by měl být použit. Tato předpona se nadále používá v případě oxidu uhelnatého vzhledem k tomu, že toto použití sahá až k prvním zábleskům chemie.
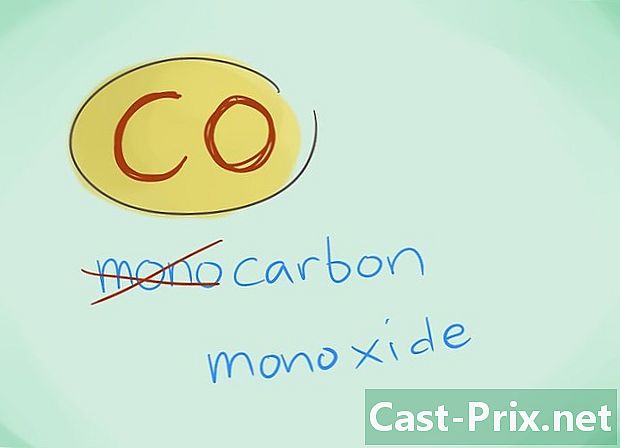
- Příklad: CO se vrátí na oxid uhelnatý, zatímco CO2 označí oxid uhličitý.
- Máte samozřejmě podezření, že na všechna tato pravidla se vztahuje několik výjimek; platí například tento vzorec, CaCl2Očekáváte, že se vám bude říkat „chlorid vápenatý“, což je NE. Vaše sloučenina si jednoduše ponechá název chlorid vápenatý.
- Je třeba také poznamenat, že to vše neplatí pro organickou chemii.
- Podrobná pravidla jsou určena pro začátečníky z chemie a vědy. Když procházíte stádiem pokročilé chemie, existují velmi odlišná pravidla, například pravidla proměnné valence.